
9月6日-7日,贵州省药监局发布了两则通告,一则是“关于贵州景峰注射剂有限公司召回参芎葡萄糖注射液进展的通告”,另一则是“关于责令贵州金宇药业有限公司召回茵栀黄软胶囊的通知”。值得注意的是,以上两个药品此次都为三级召回。
参芎葡萄糖注射液被召回
今年8月15日,贵州省药监局发布“贵州景峰注射剂有限公司关于对参芎葡萄糖注射液实施主动召回的公告”。
据悉,贵州景峰注射剂有限公司在2018年8月收到编号为WH2018YC01421的武汉药品医疗器械检验所检验报告,报告书中称,参芎葡萄糖注射液(国药准字H52020703)批号:201711130“溶液的颜色”不符合规定。至此,贵州景峰注射剂有限公司决定对参芎葡萄糖注射液实施主动召回。
8月27日,贵州景峰注射剂有限公司发布召回公告Ⅱ期。据悉,该批产品共生产38440瓶,发往武汉市汉口国药有限公司分公司2240瓶,发往九州通医药集团股份有限公司36200瓶。
截止8月27日,批号为201711130的产品已召回2450瓶。
9月7日,贵州景峰注射剂有限公司发布召回公告Ⅲ期。截止9月3日,贵州景峰注射剂有限公司已全部召回参芎葡萄糖注射液(国药准字H52020703 批号:201711130)2603瓶。
医药手机报从国家药监局数据中心发现,参芎葡萄糖注射液共有三个国药准字文号,除了贵州景峰注射剂有限公司的国药准字H52020703,其余两个为通化天实制药有限公司的国药准字H22026491和国药准字H22026492。

茵栀黄软胶囊被召回
9月5日,贵州省药监局发布“关于责令贵州金宇药业有限公司召回茵栀黄软胶囊的通知”。
据悉,原国家食品药品监督管理总局于2017年8月发布的《关于修订茵栀黄口服制剂说明书的公告》(2017年第96号),明确规定了对茵栀黄口服制剂类药品的说明书进行修订并备案,且在备案后6个月内对已出厂的药品说明书予以更换。
经查,该公司于2017年9月按照《公告》要求对说明书进行了修订并已备案,但未对备案前生产的该药品说明书进行更换,至此贵州省药监局责令召回茵栀黄软胶囊共23批次(批号:20160401至20170604),共计720件(24粒的20批660件,60粒的3批60件)。
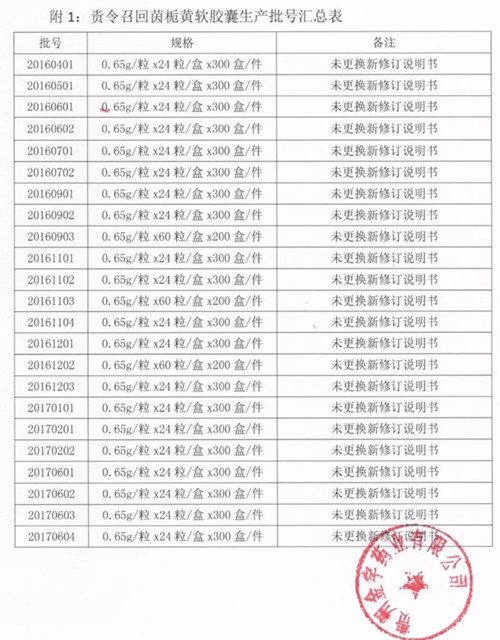
医药手机报发现,茵栀黄软胶囊在从国家药监局数据中心上有3个国药准字,其余两家分别来自江苏万高药业股份有限公司和芜湖绿叶制药有限公司。

Tips:什么是三级召回?
三级召回是指:使用该药品一般不会引起健康危害,但由于其他原因需要收回的。除此之外,还有一、二级召回。
一级召回:使用该药品可能引起严重健康危害的;二级召回:使用该药品可能引起暂时的或者可逆的健康危害的。
药品生产企业在作出药品召回决定后,应当制定召回计划并组织实施,一级召回在24小时内,二级召回在48小时内,三级召回在72小时内,通知到有关药品经营企业、使用单位停止销售和使用,同时向所在地省、自治区、直辖市药品监督管理部门报告。(医药手机报)
发布于 2018-09-13 09:04:02 IP 属地·中国|江西省|赣州市
治小儿顽咳效方 3012评论
皮肤病图片大全(1000张之多) 2829评论
医生营生绝活---简方疗便秘 2647评论
新农合受益方排名 2604评论
小儿感冒咳嗽输液特棒的方子(我的临床经验常用方) 2380评论
2011年,新的一年,基层医生网每日红包继续!!! 2368评论
灌肠治愈儿童咳嗽的处方。 1704评论
孕妇牙疼怎么办? 1703评论
看看我治疗的小儿咳嗽处方. 1564评论
搽痔疮肿痛简效方 1551评论